| 説明資料 13 |
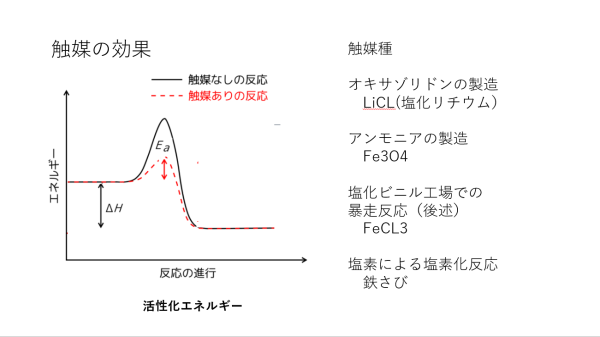
| このスライドは触媒の効果を模式的に示したものである。触媒があれば目的の反応を速く進めることができるようになる。 説明資料12においては、X+Y→Z反応の具体的例について、塩化リチウム(LiCL)が良好な触媒として働くことを説明した。 もし触媒がなければ反応は図中の黒線で示した高い山(活性化エネルギーの障壁)を越えて、左側(X+Y)から右側Zへと進まなければならず、その山を乗り越えるために大きなエネルギー、言い換えると高温を必要とする。触媒はこの山を低くする効果がある。触媒を加えた時の山を模式的に赤い線で表している。山が低くなればこの山を乗り越えるためのエネルギーも少なくて済み、これは言い換えると低い反応温度でも反応を進めることができるようになるということである。 蛇足であるが、X+Y→Z+⊿Hと、反応で発生する反応熱⊿Hは、図中にも示すように、触媒の有無にかかわらず同じである。 ハーバー・ボッシュ法によるアンモニア合成の触媒がFe3O4であることは説明資料3で述べた。 東ソー塩ビモノマー製造設備の爆発が、塩化第二鉄(FeCL3)が触媒となって予期せぬ反応が起こったためであることは説明資料15で述べる。 化学合成において塩素化反応は常用される。これは、有機化合物と塩素を反応させて、たとえば説明資料15で示すように二重結合に塩素を入れる反応、 CH2=CH2+CL2→ClCH2CH2CL、 あるいは有機化合物中の水素原子を塩素原子へと変換する反応、 C-H+CL2→C-CL+HCL、 などである。この反応において、塩素タンクから塩素化反応器への塩素供給配管内部が塩素などでさびていて、塩素ガスと共に錆が塩素化反応器中へと入り込むと、塩素と有機化合物の燃焼的な反応が起こり、事故につながることがある(塩素も立派な酸化剤である)。これを避けるために、塩素供給配管には、塩素化反応器に入る直前にフィルターを設け、錆が反応器へと入り込まないようにしてある。 |
 |
| スライド一覧に戻る |