| 説明資料 3 |
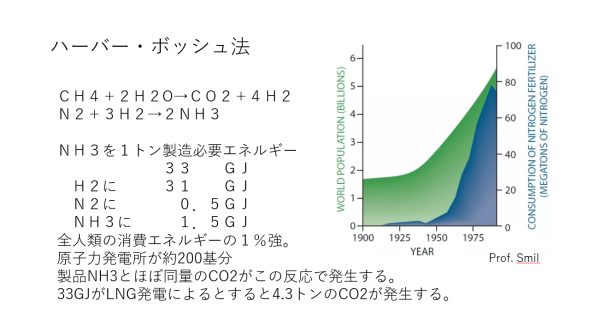
| アンモニアの製造方法である。 ハーバー・ボッシュ法でのアンモニア製造の開始は約100年前である。植物の成長に必要な肥料の三要素は窒素(N)、リン酸(PO4)、カリ(K)と言われるが、その内の窒素を人類は自由に手にすることができるようになった。これにより、食料の増産が可能となり、人口は急激に増加していくこととなった。下に示したスライドである。20世紀初頭からの全世界の人口爆発は、このハーバー・ボッシュ法の成功に起因しているとしてまず間違いないだろう。 スライドには、このアンモニア製造のために人類が使っているエネルギー量を合わせて示した。このスライドに示した数値はかなり以前の英文文献からのものであるが、改めて調べなおすと次のようになり、その数値は大きくは変化していない。近年の水素エネルギー開発の恩恵を受けて水素の製造に必要なエネルギーが低下した分だけ、アンモニアの製造に必要なエネルギーが低下したと読み取れる。 アンモニア合成の原単位(プロセスエンジニアのためのウェブサイト) NH3を1トン製造するのに要するエネルギー 合計 29 GJ CH4改質H2製造に 25.8GJ 深冷分離N2製造に 0.5GJ NH3合成に 2.7GJ (参考)PSAによる水素精製に 0.33kWh/Nm3-H2 NH3を1トン製造当たり2.3GJ ※ Gはギガで10の9乗を表す PSAは圧力変動吸着法(Pressure Swing Adsorption) アンモニア製造の化学式は次のとおりである(平衡反応)。 N2 + 3H2 ⇌ 2NH3+発熱 アンモニアを効率的に製造するにはルシャトリエの原理(Wikipedia、アンモニア合成を例に平衡が論じられている)より、反応温度はできるだけ低く、圧力はできるだけ高くが理想となる。実際には次の条件で製造されている(ハーバー・ボッシュ法、Wikipedia)。 現代の量産プラントでは、25-35MPa・約500℃で反応させ、触媒を通した後アンモニアは -33℃ 程度まで冷却され、液体の状態で排出し適当な平衡定数を維持する。未反応の水素と窒素は循環し再び触媒床に通される。 このアンモニア製造にはFe3O4系触媒が用いられている(ハーバー・ボッシュ法(Wikipedia))。この触媒は寿命が長く、ほとんど詰め替えの必要がないとのことで、触媒寿命からは好ましい触媒である。しかし、現在の高い反応温度では1回の反応当たりのアンモニア収率が悪く(約10%?)、反応ガスからアンモニアを低温で凝縮・回収した後の未反応窒素と水素を再度反応にリサイクルしている。この反応温度を少しでも低くできれば、反応収率の向上と熱負荷が軽減され、製造原価の低減並びにプラント当たりの生産量の増加が見込める。このため、最近ではルテニウム(Ru)系の触媒開発が精力的に行われている。 アンモニアは上でも示したように、食糧生産のためにもその窒素源として有用である。また、説明資料25でも示すように、硝酸および硝酸アンモニウムの原料としても重要な化合物である。 参考までに、次のブログも示す。 ハーバー・ボッシュ法のアンモニア合成が全世界の人口を支える |
 |
| スライド一覧に戻る |