| 説明資料 12 |
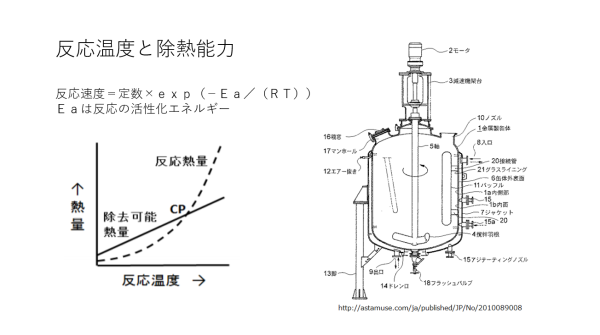
| スライド1の左図は横軸に反応温度、縦軸に熱量を取っている。曲線は反応に伴う発熱量、そして直線は除熱量を示し、この曲線と直線が交わる点CP(Critical Point)で反応熱の除熱ができなくなることを示している。この図は「化学反応の暴走事故とその分類、および予防策」より引用した。 スライド1の右図には一般的な反応器の図を示したが、反応器の外壁を冷却液が流れ、反応で生じた熱量を除去する仕組みとなっている。除去できる熱量は、反応温度と冷却液の温度差に比例するので、左図で除熱量は直線として表わされる。 反応暴走の根本原因は反応熱が除去できなくなるところにある。一般的な化学反応では反応の活性化エネルギーは30kcal/mol程度である。この活性化エネルギーでは、反応温度100℃付近で行う反応であれば、反応温度が10℃高くなると反応速度は約3倍、同様に200℃の反応温度であれば反応速度は約2倍となる。反応速度が速くなればそれに比例して反応熱が発生するので、冷却が追いつかなくなる。その結果、反応は暴走に至る。 この反応暴走を避けるために、一般的には、たとえば、X+Y→Z、原料Xと原料Yを反応させて生成物Zを得る反応であれば、原料Xを反応器に仕込みそこに反応の状況を見ながら原料Yを徐々に加えていく方法がとられる。この条件から逸脱し、反応熱量が左図のCPよりも大きくなった時、重大な事故を引き起こすことになる。 スライド2は化学反応の実際の暴走を示したものである。反応器に原料X(液体、エポキシ化合物)と反応触媒(固体、塩化リチウムLiCL)を加えて、そこに原料Y(液体、イソシアネート)を滴下しながら反応を行わせようとした。反応液の温度を80℃に保ったが、原料Yの滴下が終了しても発熱は認められず反応が進んだ形跡がない。滴下終了後、2~3時間は温度の変化はほとんどなく、反応はほとんど進んでいない。しかし、この反応はある時点で急激に進み、その反応温度は10分間で80℃から一気に160℃まで上昇する。反応器は80℃のオイルバスに浸してあるから、冷却効果があるのだがこの状況である。 この時の反応は次のように説明できる。反応は塩化リチウムが触媒となって進むが、初期には反応液に固体塩化リチウムが溶解していないためその反応が遅々として進まない。反応が進み始めると反応熱により反応液温が上昇して、しかも触媒である塩化リチウムの反応液への溶解度も温度の上昇と共に向上するため、反応温度上昇と反応液中の媒塩化リチウム濃度の向上が相まって一気に反応速度が進む。 反応温度が高くなると副反応が起こり、目的の生成物Z以外の化合物も多く生成してくる。その結果、収率と製品純度共に悪い結果となる。この反応をうまく進めるカギは、触媒の塩化リチウムが反応液に溶解していることである。そこで、触媒塩化リチウムの溶解した前回の反応液の10分の1量を次の反応へとリサイクルすると、反応温度80℃で反応はスムーズに進み、収率と製品純度が共に大きく向上する。 化学反応はちょっとした工夫で、工業的製法に変えられる良い事例である。この特許はこちらから見ることができる。 |
 |
 |
| スライド一覧に戻る |